Equació de Butler-Volmer
L'equació de Butler–Volmer és una de les fórmules fonamentals de la cinètica electroquímica. Descriu com el corrent elèctric a través d'un elèctrode depèn de la diferència de potencial entre l'elèctrode i el si de la solució per a una reacció redox senzilla i unimolecular, considerant que tant la reacció catòdica com l'anòdica tenen lloc en un mateix elèctrode.[1] L'equació va ser formulada per John Alfred Valentine Butler[2] i Max Volmer.
Definició de l'equació
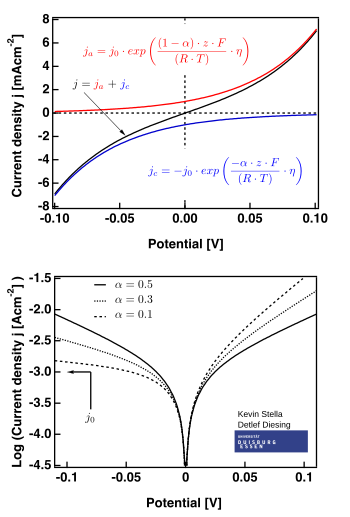
Tenint en compte que la densitat de corrent té una component anòdica i catòdica,
l'equació de Butler–Volmer és:
o en una forma més compacta:
on:
- : densitat de corrent de l'elèctrode, A/m²
- : densitat de corrent de bescanvi, A/m²
- : potencial d'elèctrode, V
- : Potencial d'equilibri, V
- : Temperatura absoluta, K
- : Nombre d'electrons implicats en la reacció elèctròdica
- : Constant de Faraday
- : Constant de gas universal
- : coeficient de transferència de càrrega catòdic, adimensional
- : coeficient de transferència de càrrega anòdic, adimensional
- : sobrepotencial ().
Referències
- ↑ Adler, S.B.. «Chapter 11: Sources of cell and electrode polarisation losses in SOFCs». A: Kendall. High-Temperature Solid Oxide Fuel Cells for the 21st Century. 2nd. Academic Press, 2016. DOI 10.1016/C2011-0-09278-5. ISBN 9780124104532.
- ↑ Mayneord, W. V. Biographical Memoirs of Fellows of the Royal Society, 25, 1979, pàg. 144–178. DOI: 10.1098/rsbm.1979.0004. PMID: 11615791.

![{\displaystyle j=j_{0}\cdot \left\{\exp \left[{\frac {\alpha _{\rm {a}}zF}{RT}}(E-E_{\rm {eq}})\right]-\exp \left[-{\frac {\alpha _{\rm {c}}zF}{RT}}(E-E_{\rm {eq}})\right]\right\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f04ada917b1e46ab7d26da3300b2f080d9fd591a)
![{\displaystyle j=j_{0}\cdot \left\{\exp \left[{\frac {\alpha _{a}zF\eta }{RT}}\right]-\exp \left[-{\frac {\alpha _{c}zF\eta }{RT}}\right]\right\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90c978bf8f380997d326539e24955e0ba8bd3123)











