Bezwodnik ftalowy
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C8H4O3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | C6H4(CO)2O | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 148,12 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | białe płatki[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 85-44-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6811 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bezwodnik ftalowy – organiczny związek chemiczny, bezwodnik kwasu ftalowego. Bezbarwne ciało stałe krystalizujące w formie igieł, słabo rozpuszczalne w wodzie, alkoholu etylowym i eterze dietylowym, dobrze w estrach i ketonach. Pod wpływem wilgoci ulega hydrolizie do kwasu ftalowego.
Otrzymywanie
Po raz pierwszy otrzymany w 1836 roku przez Augusta Laurenta w wyniku katalitycznego utleniania naftalenu, którą to metodę stosuje się do dziś. Obecnie głównym źródłem przemysłowym jest utlenianie ortoksylenu[6]. Bezwodnik można także uzyskać bezpośrednio poprzez dehydratację kwasu ftalowego:

Zastosowanie
Stosowany jako substrat do produkcji plastyfikatorów będących głównie estrami ftalowymi i wypełniaczy do polimerów oraz barwników. W wyniku kondensacji z fenolem tworzy fenoloftaleinę, używaną jako wskaźnik kwasowo-zasadowy. Ważnym zastosowaniem jest produkcja antrachinonu i jego pochodnych, w wyniku acylowania Friedla-Craftsa z benzenem i dehydratacji powstającego ketokwasu kwasem siarkowym[7]
W reakcji ze stężonym amoniakiem daje ftalimid, ważny substrat syntezy Gabriela: 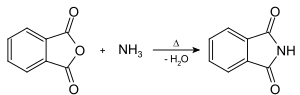
W wyniku reakcji z wodą hydrolizuje do kwasu ftalowego. Z zasadami tworzy sole, z alkoholami estry – ftalany.
Przypisy
- ↑ a b Bezwodnik ftalowy (nr 320064) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ a b c d e f g h Department of Chemistry, The University of Akron: Phthalic anhydride. [dostęp 2012-03-23]. (ang.).
- ↑ a b Phthalic anhydride, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2012-03-23] (ang.).
- ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4 .
- ↑ a b Bezwodnik ftalowy, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-04-10] (ang.).
- ↑ Sulzer Chemtech – Phthalic anhydride production
- ↑ Anthrachinonfarbstoffe
- Britannica: science/phthalic-anhydride


















