Hrom pentafluorid
 | |
| Nazivi | |
|---|---|
| IUPAC naziv Hrom(V) fluorid | |
| Drugi nazivi Hrom fluorid, hrom(V) fluorid, pentafluorohrom, pentafluoridohrom | |
| Identifikacija | |
| |
3D model (Jmol) |
|
| ChemSpider |
|
PubChem[1][2] C ID |
|
SMILES
| |
| Svojstva | |
| CrF5 | |
| Molarna masa | 291,71 g/mol |
| Agregatno stanje | crveni kristali[3] |
| Gustina | 2,89 g/cm3[3] |
| Tačka topljenja | 34 °C (93 °F; 307 K)[3] |
| Tačka ključanja | 117 °C (243 °F; 390 K)[3] |
| Struktura | |
| Kristalna rešetka/struktura | Orthorhombic[3] |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Hrom pentafluorid je neorgansko jedinjenje sa hemijskom formulom CrF5.[4] To je crvena isparljiva čvrsta materija koja se topi na 30 °C; lako se hidrolizuje do hroma(III) i hroma(VI).[5] Ovo jedinjenje ima istu kristalnu strukturu kao i vanadijum pentafluorid.[6] Ono ima najviše oksidaciono stanje među poznatim fluoridima hroma, pošto hipotetični hrom heksafluorid još uvek nije sintetisan.[7]
Hrom pentafluorid je jedan od produkata dejstva fluora na smešu kalijumnih i hromnih hlorida.[8]
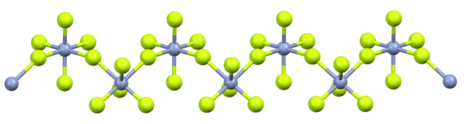
U pogledu strukture, ovo jedinjenje je jednodimenzioni koordinacioni polimer. Svaki Cr(V) centar ima oktaedralnu molekularnu geometriju.[9]
Vidi još
- Hrom difluorid
- Hrom trifluorid
- Hrom tetrafluorid
Reference
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003. уреди
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г д Perry, Dale L. (2011). Handbook of Inorganic Compounds, Second Edition. Boca Raton, Florida: CRC Press. стр. 125. ISBN 978-1-43981462-8. Приступљено 2014-01-10.
- ^ Jacques Guertin; James A. Jacobs; Cynthia P. Avakian, ур. (2004). Chromium(VI) Handbook. CRC Press. стр. 30. ISBN 9780203487969.
- ^ Amit Aora (2005). Text Book Of Inorganic Chemistry. Discovery Publishing House. стр. 649.
- ^ A. G. Sharpe (1983). Advances in Inorganic Chemistry. 27. Academic Press. стр. 103. ISBN 9780080578767.
- ^ Riedel, Sebastian; Kaupp, Martin (2009). „The highest oxidation states of the transition metal elements” (PDF). Coordination Chemistry Reviews. 253 (5–6): 606—624. doi:10.1016/j.ccr.2008.07.014. Архивирано из оригинала (PDF) 04. 06. 2013. г. Приступљено 07. 01. 2017.
- ^ A. G. Sharpe (2012). J.H. Simons, ур. Fluorine Chemistry. 2. Elsevier. стр. 24. ISBN 9780323145435.
- ^ Shorafa, H.; Seppelt, K. „The structures of CrF5 and CrF5*SbF5”. Zeitschrift für Anorganische und Allgemeine Chemie. 635: p112—p114. 2009. CS1 одржавање: Текст вишка: странице (веза)









